


 Несоблюдение правил хранения может привести к порче продукции. Гарантия производителя на изделия из оцинкованной стали предоставляется только в том случае, если соблюдены все условия транспортировки, хранения и монтажа изделий.
Несоблюдение правил хранения может привести к порче продукции. Гарантия производителя на изделия из оцинкованной стали предоставляется только в том случае, если соблюдены все условия транспортировки, хранения и монтажа изделий.
Основой оцинкованных изделий служит стальной лист, на котором под внешним воздействием атмосферы возможно возникновение коррозии. Чтобы этого избежать тонколистый стальной прокат обработан несколькими защитными слоями: цинковым и несколькими полимерными покрытиями, которые препятствуют прямому контакту стали с внешней средой.
Если оцинкованная сталь подвергается воздействию влаги (дождь, роса, конденсат) в среде, где не хватает кислорода, то вода быстро реагирует с цинком и постепенно разъедает покрытие. Наиболее распространённые условия, в которых появляется белая ржавчина, — изделия хранятся в заводской упаковке и/или плотно прижатыми друг к другу.
Физико-химические процессы разрушения металла
Коррозия — это самопроизвольно протекающий процесс разрушения металла, вследствие химического или электрохимического взаимодействия металла с окружающей средой.
Различают химическую и электрохимическую коррозию.
Химическая коррозия — коррозия металла в газовой и жидкостной среде, не проводящей ток. Коррозия этого вида состоит в окислении металла в результате непосредственного его химического взаимодействия с окружающей средой. В таких средах, как воздух, продукты сгорания каменного угля и других видов топлива (нефть, бензин, керосин, смазочные масла) обычно развивается химическая коррозия.
Но наличие даже небольших количеств влаги в указанных веществах может в большей или меньшей степени сообщить коррозии электрохимический характер. Химическая коррозия в чистом виде — достаточно специфическое явление, преобладающее в средах, достаточно закрытых для окружающего природного воздействия. Большое практическое значение имеет электрохимическая коррозия.
Электрохимическая коррозия
Электрохимическая коррозия имеет характер анодного окисления металла, которое может протекать по двум различным механизмам:
– гальванокоррозия — окисление металла, являющегося анодом самопроизвольно возникающей гальванической цепи;
– электрокоррозия — окисление металла, являющегося анодом своеобразной электролизной системы, самопроизвольно возникающей под влиянием тока от внешнего источника.
Гальванокоррозия
При гальванокоррозии основная масса металла обычно играет роль анода. В качестве материала катода могут служить самые разнообразные вещества, но обязательно являющиеся электронными проводниками. Сюда относятся более электронофильные металлы, чем анод. Например, по отношению к железному аноду такими металлами являются Sn, Pb, Cu, Hg, Ag и т.п. Роль катодов может выполнять и ряд электропроводящих неметаллических материалов, среди которых назовём ржавчину, зёрна графита, угля, цементита (карбида железа Fe3C), шлаковые включения в металл и т.д.
Процессы, протекающие при гальванокоррозии, рассмотрим на двух примерах, представляющих практический интерес: коррозию железа в контакте: а) с цинком и б) с оловом во влажном воздухе.
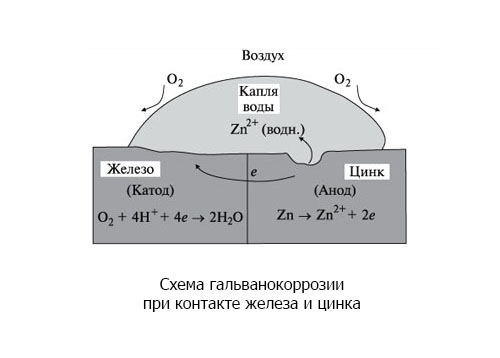 а) Коррозионный процесс в гальванопаре Zn/Fe. Цинк, как сравнительно более химически активный металл, подвергается анодному окислению и переходит в состояние ионов.
а) Коррозионный процесс в гальванопаре Zn/Fe. Цинк, как сравнительно более химически активный металл, подвергается анодному окислению и переходит в состояние ионов.
Реакция на аноде**: 2Zn – 4e- → 2Zn** (окисление).
Реакция на катоде: 2H2O + O2 + 4e- → 4OH’ (восстановление).
Вторичная реакция: 2Zn** + 4OH’ → 2Zn(OH)2.
В процессе работы коррозионной гальванопары Zn/Fe окисляется, разрушается цинк. За счёт электронов последнего железо предохраняется от коррозии.
б) Коррозионный процесс в гальванопаре Sn/Fe. В данном случае железо более химически активный металл, чем олово. Катодом гальванопары будет олово, а анодом — железо.
Реакция на аноде**: 2Fe – 4e- → 2Fe** (окисление).
Реакция на катоде: 2H2O + O2 + 4e- → 4OH’ (восстановление).
Они приводят к образованию бурой ржавчины.
Таким образом, в процессе работы рассматриваемой гальванопары окисляется и разрушается железо, а олово остается без изменения.
На практике подобные явления встречаются при коррозии оцинкованного и луженого железа. В случае нанесения на железо менее химически активного металла (Sn, Cu, Ni, Cr, Ag, Au), для придания поверхности декоративных и других полезных свойств, защита железа происходит путем его изоляции от внешней среды. При повреждении внешнего защитного слоя начинают протекать описанные реакции и железо ржавеет.
Коррозионные элементы могут возникать во всех случаях, когда в присутствии электролита соприкасаются металлы, различающиеся между собой электродными потенциалами.
Особо нужно отметить влияние температуры. Повышение температуры ускоряет физические и химические процессы. В водной среде это особенно заметно при температуре около 60°С. При температуре около 70°С в гальванопаре Zn/Fe может произойти изменение потенциала цинка, в результате чего цинковое покрытие становится катодам, а железо анодом. Отмечают, что изменению полярности цинка способствуют низкое содержание в воде кислорода и высокое бикарбонатов. В таких условиях коррозировать будет железо.
Электрокоррозия
К электрокоррозии относятся случаи электрохимической коррозии металлов, протекающие под влиянием электрического тока от внешнего источника. Здесь в основе явления, как уже отмечалось, лежит самопроизвольно возникающий процесс электролиза. В качестве примера рассмотрим электрокоррозию под влиянием так называемых блуждающих токов.
Металлические листы с полимерным покрытием, сложенные в пачку, представляют собой электрический конденсатор, где металлическая основа листа представляет собой обкладки конденсатора, а полимерное покрытие — диэлектрический слой между обкладками. В следствие неравномерности нагрева листов, воздействия внешних источников энергии и других факторов окружающей среды между различными листами пачки могут возникать разности электрического потенциала.
 В воде любого типа в большем или меньшем количестве содержатся растворенные соли, коллоидные и взвешенные вещества, живые микроорганизмы, в воду попадают частицы пыли и дыма. Поэтому при изучении поведения цинка и цинковых покрытий в водных средах воду следует рассматривать как коррозионный электролит. Если торцевую часть листов с разностью электрических потенциалов поместить в раствор соли, которым могут являться атмосферные осадки и конденсат, то возникает естественный процесс электролиза. На одном из листов, на его торцевой части, будет происходить анодное окисление металла, т.е. его коррозия.
В воде любого типа в большем или меньшем количестве содержатся растворенные соли, коллоидные и взвешенные вещества, живые микроорганизмы, в воду попадают частицы пыли и дыма. Поэтому при изучении поведения цинка и цинковых покрытий в водных средах воду следует рассматривать как коррозионный электролит. Если торцевую часть листов с разностью электрических потенциалов поместить в раствор соли, которым могут являться атмосферные осадки и конденсат, то возникает естественный процесс электролиза. На одном из листов, на его торцевой части, будет происходить анодное окисление металла, т.е. его коррозия.
Состав электролита, в особенности величина его рН, существенно влияет на скорость коррозии. Так, повышение концентрации Н’-ионов (кислая среда), как правило, резко убыстряет разрушение металла.
Повышение концентрации ОН’-ионов (щелочная среда) в электролите замедляет коррозию таких металлов, как Fe, Mg в следствии образования гидроокисных защитных плёнок.
У металлов Al, Zn, Pb повышение щелочности среды на разрушение этих металлов действует убыстряющим образом т.к. гидроокиси этих металлов растворимы в щелочах. Описанная особенность этих металлов является причиной такого явления как белая ржавчина.
Белая ржавчина на цинковом покрытии
Цинк — сравнительно реактивный металл, он активно реагирует с кислотами и щелочами. Лучше всего он проявляет свои антикоррозионные свойства в рН нейтральной среде. Долговечность цинкового покрытия зависит от формирования оксидно-карбонатной пленки. После окончательного формирования оксидно-карбонатной пленки уровень коррозии цинковых покрытий становится очень низким — не более двух микрон в год в нейтральной среде.
Химические реакции, требуемые для формирования этой плёнки, занимают некоторое время (от нескольких недель до нескольких месяцев):
1. Фаза окисления 2Zn + O2 = 2ZnO
2. Фаза гидратации 2Zn = 2H2O + O2 = 2Zn(OH)2
3. Карбонизации 5Zn(OH)2 = 2CO2 + 2ZnCO3.3Zn(OH)2 + 2H2O
На последнем этапе окончательно формируется трудно растворимый основной карбонат цинка, который обеспечивает надежную антикоррозионную защиту цинковому слою при негативном воздействии влаги. В условиях относительно сухой среды протекают все три реакции, и на поверхности оцинкованного изделия формируется оксидно-карбонатная плёнка, будучи почти непроницаемой для кислорода и влаги, резко ограничивает дальнейший процесс взаимодействия цинка с кислородом.
Иное происходит, если изделие свежеоцинкованное или на нём присутствуют места без сформированного плёночного покрытия (в частности, срезы профилированной продукции) хранится в условиях, когда на него воздействует дождь, роса, конденсат, а подвод углекислого газа и кислорода, способствующего образованию плотной оксидно-карбонатной пленки затруднен. В этом случает происходят только фазы окисления и гидратации. В результате получаются гидроксид и оксид цинка — вещества в виде белого порошка, обладающие низкой адгезионной способностью к поверхности, легко пропускающие кислород к цинку, допускающие его последующее окисление и развитие процессов образования белой ржавчины.
 Еще одним случаем, представляющим опасность образования белой ржавчины, являются участки соприкасающихся между собой поверхностей оцинкованных изделий с уже окончательно сформировавшейся оксидно-карбонатной плёнкой. В этих местах задерживается дождевая влага (или конденсируется влага из воздуха при нахождении изделий на воздухе при температуре ниже точки росы), а испаряется она в последнюю очередь. Во всех природных водах присутствует углекислота, которая может находиться в воде в виде растворенного газа СО2 и недиссоциированных молекул Н2СО3 или ионов НСО3- и СО3в2-. Углекислота и присутствующие в воде нитраты, сульфаты, хлориды без доступа кислорода разрушают образующуюся на поверхности цинка оксидно-карбонатную пленку и тем самым усиливают коррозию, приводящую к образованию белой ржавчины.
Еще одним случаем, представляющим опасность образования белой ржавчины, являются участки соприкасающихся между собой поверхностей оцинкованных изделий с уже окончательно сформировавшейся оксидно-карбонатной плёнкой. В этих местах задерживается дождевая влага (или конденсируется влага из воздуха при нахождении изделий на воздухе при температуре ниже точки росы), а испаряется она в последнюю очередь. Во всех природных водах присутствует углекислота, которая может находиться в воде в виде растворенного газа СО2 и недиссоциированных молекул Н2СО3 или ионов НСО3- и СО3в2-. Углекислота и присутствующие в воде нитраты, сульфаты, хлориды без доступа кислорода разрушают образующуюся на поверхности цинка оксидно-карбонатную пленку и тем самым усиливают коррозию, приводящую к образованию белой ржавчины.
При очень длительном хранении (от полугода) оцинкованных изделий с полимерным покрытием в неблагоприятных условиях, оксид и гидроксид цинка — вещества в виде белого порошка может выделяться и на поверхности полимерного покрытия (в особенности на обратной стороне листа, который как правило покрыт только грунтовым полимерным слоем).
В благоприятных (для белой ржавчины) условиях разъедание цинка может происходить при уровнях коррозии в 20–50 раз больших, чем обычно предполагается.
Условия хранения и эксплуатации
Из всего вышеизложенного можно сделать следующие выводы.
Цинковое покрытие стальных изделий хорошо работает как защитный слой в нейтральной сухой или влажной воздушной среде и при кратковременном воздействии воды со свободным доступом кислорода. При таких условиях работает эффект гальванопары Zn/Fe — эффект оксидно-карбонатной пленки. Такие условия соответствуют нормальным условиям эксплуатации изделий.
В случае долговременного нахождения стальных оцинкованных изделий, сложенных в пачку, в водной среде при ограниченном доступе кислорода и повышенной температуре (более 70°С), начинают протекать реакции, при которых защитные эффекты перестают работать. Происходит активное разрушение защитного слоя. Как правило, такие негативные условия складываются при неправильном хранении изделий. При нарушении условий хранения риск поражения коррозией значительно выше, чем при неправильной эксплуатации или монтаже.
Правила хранения оцинкованных изделий:

• Изделия хранятся в заводской упаковке НЕ более 1 (одной) недели с даты поставки. Пачки в заводской упаковке укладываются на ровное место на бруски с шагом 0,5 м.
• При необходимости хранения профилированной продукции более 1 (одной) недели ее размещают под навесами или в крытых неотапливаемых, сухих помещениях без прямого воздействия солнечных лучей и осадков (в соответствии с ГОСТ 7566).
Изделия следует распаковать (снять заводскую упаковку), расположить на ровной поверхности и переложить каждый лист одинаковыми рейками (штабель высотой до 70 см).
• Хранение на открытом воздухе допускается только на период монтажных работ. Изделия должны быть расположены под небольшим наклоном в 3° так, чтобы между ними обеспечивались свободная циркуляция воздуха и слив воды.
• Максимальный срок хранения во всех вышеперечисленных условиях не должен превышать 2 (двух) месяцев с даты поставки.